Modelos Atômicos
- Gustavo H. Sahd e Milena C. P. Ferruzzi
- 18 de out. de 2022
- 4 min de leitura
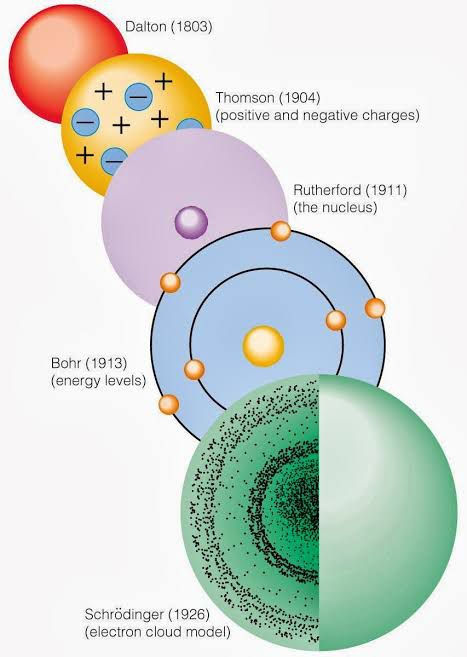
A ideia de átomo surgiu na Grécia antiga com Leucipo e Demócrito. Eles foram um dos primeiros a propor a ideia de átomo como componente de toda a matéria existente e indivisíveis. Ao longo dos séculos muitos cientistas tentaram definir o átomo quanto a sua forma, dando origem a diversas teorias sobre sua constituição física. Surgiram, então, as diferentes concepções de modelos atômicos, e entre eles, podemos listar:
:- Modelo atômico de Demócrito: - 460 a.C. — 370 a.C.
Demócrito afirma em sua teoria que o universo tem uma constituição elementar única: o átomo - partícula invisível, indivisível e impenetrável. Em sua concepção, as vibrações dos átomos provocam todas as nossas sensações.
Esse modelo comporta interações entre o que chamamos hoje de vácuo e os átomos, que Demócrito chamava de ente (matéria) e não ente (vácuo) os quais, juntos, compunham a realidade. Essa relação dava origem ao movimento.
À época também foi postulado que aos átomos cabiam as seguintes propriedades: movimento, forma e impenetrabilidade e que por meio de choques entre si ocorria a associação ou dissociação de átomos, surgindo, desse processo, as diferentes substâncias que conhecemos hoje como moléculas.
- Modelo de Dalton (“bola de bilhar”) – 1803
Dalton propôs a primeira teoria científica para tentar explicar a partícula elementar. Para ele, a teoria de Leucipo e Demócrito era coerente. Segundo este modelo, os átomos eram as menores partículas possíveis, assumindo formas esféricas e possuindo massas semelhantes caso fossem correspondentes aos mesmos elementos químicos.
Um dos postulados propostos por Dalton era de que os átomos de diferentes elementos possuíam propriedades distintas, mas os átomos do mesmo elemento deveriam possuir as mesmas propriedades e que nos processos de reações químicas os átomos não se alterariam.
- Modelo de Thomson (“pudim de passas”) – 1897
Com o avanço das teorias sobre os fenômenos elétricos e os estudos sobre radiação, o modelo de Dalton tornou-se obsoleto. Dessa forma, com os estudos de Thomson, um novo modelo foi idealizado, no qual o átomo era uma esfera de carga elétrica positiva incrustada com elétrons (carga negativa), tornando-se, assim, eletricamente neutro.
Os elétrons não são fixos aos átomos. Em determinadas condições, eles podem ser transferidos para outros. Portanto, esse modelo quebrava com a ideia do átomo ser a partícula fundamental e indivisível. Com relação ao modelo de Dalton, Thomson já havia reconhecido a natureza elétrica da matéria (elemento que não era previsto por Dalton).
- Modelo de Rutherford-Bohr (“sistema planetário”) – 1908-1910
Rutherford, ao bombardear partículas alfa sobre uma lâmina de ouro, percebeu que a maioria atravessava a lâmina. Uma parte menor sofria um pequeno desvio, enquanto uma outra sofria um desvio contrário à trajetória. A partir disso, foi possível perceber que os átomos não eram maciços, mas providos de um grande espaço vazio. Deveriam ser, pois, constituídos por um núcleo carregado positivamente e uma nuvem eletrônica carregada negativamente. Essa nuvem eletrônica deveria ser composta por elétrons que giravam em órbitas elípticas ao redor do núcleo (assim como os planetas ao redor do sol). Também foi reconhecido que a maior parte da massa de um átomo se concentra no núcleo (que rebatia as partículas alfa no sentido contrário do bombardeio).
- Modelo atômico de Bohr - 1913
Dois anos após Rutherford ter exposto o seu modelo atômico, Bohr o aperfeiçoou> Seu modelo pode ser fundamentado em três postulados:
1. Os elétrons descrevem, ao redor do núcleo, órbitas circulares com energia fixa e determinada, sendo denominadas órbitas estacionárias;
2. Durante o movimento nas órbitas estacionárias, os elétrons não emitem energia espontaneamente;
3. Quando um elétron recebe energia suficiente do meio externo, realiza um salto quântico: migra entre dois orbitais. E, como tende a voltar ao orbital inicial, a energia recebida é emitida na mesma quantidade para o meio, sendo essa energia (recebida e emitida) a diferença energética entre os dois orbitais.
Apesar de bastante difundida no Ensino Médio, o modelo atômico de Rutherford-Bohr é, em parte, ineficiente, pois:
os elétrons, na prática, não realizam trajetórias circulares ou elípticas ao redor do núcleo;
não deixa claro o porquê os elétrons não perdem energia durante seu movimento;
não explica a eletrosfera de átomos que possuem muitos elétrons.
Dessa forma, o modelo atômico ideal está sendo obtido a cada dia em que se descobrem mais informações acerca da estrutura íntima da matéria.
Modelo da Nuvem Eletrônica Do Átomo - 1913-1919
O modelo atómico tido como o mais correto, com base nos conhecimentos que hoje temos, é o Modelo da Nuvem Electrónica, que diz que:
a zona central do átomo, a que se dá o nome de núcleo, é constituída por prótons (partículas com carga positiva) e nêutrons (partículas com carga neutra);
à volta do núcleo do átomo giram os elétrons;
os elétrons não têm órbitas bem definidos, possuem, antes, movimentos aleatórios em torno do núcleo do átomo;
na nuvem eletrônica, há elétrons que se encontram preferencialmente mais próximos do núcleo e outros que se encontram preferencialmente mais afastados;
o núcleo é muito pequeno quando comparado ao tamanho da nuvem eletrônica. É possível por isso concluir que a maior parte do átomo é espaço vazio.
Referências:
[1] Stoodi. Disponível em: <https://www.stoodi.com.br/blog/quimica/modelos-atomicos/>. Acesso em 12 de outubro de 2022.
[2] Manual da Química. Disponível em: <https://www.manualdaquimica.com/quimica-geral/evolucao-dos-modelos-atomicos.htm>. Acesso em 12 de outubro de 2022.



Comments